

Probability of free from all-cause death
Probability of free from all-cause death or rehospitalization
Probability of free from rehospitalization
Follow-up(Days)
Follow-up(Days) Follow-up(Days)
A
C
B
Probability of free from all-cause death or rehospitalization
Probability of free from rehospitalization
Follow-up(Days)
Follow-up(Days) Follow-up(Days)
A
C
B
4 合併症を有する患者での心不全治療
① 高血圧合併例の治療
1)病態
病態の進行した心不全患者では血圧が低下した症例が多いが,高血圧を合併する症例では心機能改善・病態進行抑制のために,心不全に対する一般的な治療法に加えて高血圧治療が重要になる.高血圧は,収縮期・拡張期の圧負荷の増大によって左室の収縮・拡張機能に障害をもたらす246).高血圧は,左室リモデリングを促進し,壁ストレス増大による酸素消費量増加,微小循環障害や冠動脈内皮障害による心筋虚血によって心筋障害を進展させる.心不全患者の急性期と慢性期の予後改善にとって,高血圧の適正な管理は極めて重要である.我が国の疫学研究によって,高血圧は心不全の基礎疾患として冠動脈疾患や拡張型心筋症と共に頻度が高いことが示されている247),248).また,大規模臨床試験の成績では,降圧治療により,高血圧患者における心不全発症率が減少することが明らかにされている249)-251).
2)治療
高血圧治療ガイドライン2009(日本高血圧学会)では,心血管病を有する高血圧患者は高リスク群に分類され,生活習慣是正と降圧薬治療をただちに開始することを薦めている252).薬剤選択に関しては,降圧をはかりつつ心不全の治療を行うことが原則となる.我が国を含む多くの大規模臨床試験で,ACE阻害薬,およびARBと
β遮断薬は心不全患者の長期予後を改善することが明らかにされている171),173),176)-181),212).したがって,心不全を合併する高血圧には,ACE阻害薬,ARB,β遮断薬の単独ないし併用が良い適応になる.降圧効果が不十分な場合や,臓器うっ血を伴う心不全では利尿薬が使用され,十分な降圧が得られる場合心不全発症を有意に抑制する250).さらに降圧が必要である場合は,アルドステロン拮抗薬であるスピロノラクトンやエプレレノンの使用が推薦され,予後改善効果38),39)も示されている.長時間作用型のジヒドロピリジン系カルシウム拮抗薬は,心不全患者の予後を増悪させないことが明らかにされており,安全に使用することができると考えられる200).収縮能が保持された心不全の治療エビデンスは不十分であるが,十分な血圧管理が必須と考えられている.高血圧を合併した心不全患者の降圧目標値は症例によって異なると思われるが,130/80 mmHg未満とする報告が多い118),253).降圧目標を達成した後は,過度の低血圧を来たさない限り,予後改善を目的とする心不全加療を十分に施行することが重要である.
高血圧を合併した収縮能が低下した心不全に対する治療
ClassⅠ
● ACE阻害薬(エビデンスレベルA)
● ARB(エビデンスレベルA)
● β遮断薬(エビデンスレベルA)
● 利尿薬(エビデンスレベルB)
● アルドステロン拮抗薬(エビデンスレベルB)
ClassⅡ a
● カルシウム拮抗薬(注1,エビデンスレベルB)
(注1) 長時間作用型のジヒドロピリジン系カルシウム拮抗薬以外は心抑制作用のため使用を避けるべきと考えられている.
高血圧を合併した収縮能が保持された心不全に対する治療
ClassⅡ a
● ACE阻害薬(エビデンスレベルC)
● ARB(エビデンスレベルC)
② 冠動脈疾患合併例の治療
1)病態
心不全の背景疾患として冠動脈疾患は,高血圧や拡張型心筋症とともに頻度が高い248).心筋虚血は,収縮機能と拡張機能の双方を障害し,心筋梗塞による心筋傷害は心室機能不全の原因となる.心不全に狭心症を合併すると,運動耐容能はさらに低下し,心筋虚血は心不全を増悪させる.また心不全は心筋虚血を増強して悪循環を形成する.我が国の報告では,虚血性心疾患を背景とする心不全患者の予後は,非虚血性心疾患を背景とする症例に比べて不良であった253).冠動脈疾患を合併した心不全患者の治療においては,狭心症の存在によって低下したQOLと心筋虚血や心筋傷害によって惹起された心機能低下の両面に対する対策が必要である.
2)治療
非薬物治療であるが,冠動脈疾患を合併した心不全症例における狭心症治療・血行再建の効果については確立したエビデンスが存在しない.しかし,経皮的冠動脈インターベンション(PCI)や冠動脈バイパス術による心機能の回復効果は十分に期待され254),255),狭心症症状を示す症例や,虚血が心機能低下の原因と証明された症例では,よく検討した上で選択されるべき治療法である256),257).
薬物治療を行うにあたっては,(1)心筋虚血,(2)心不全,(3)冠危険因子を含めた二次予防への効果を考慮して選択する.β遮断薬は左心室駆出率の低下した心不全症例において症状や,血行動態を改善し,再梗塞と死亡リスクを軽減する161),182),183),186).心不全増悪を配慮して少量より開始されるため,狭心症を有する症例で狭心症治療効果が不十分な場合は他の抗狭心症薬を併用する.また,冠攣縮性狭心症合併例では,増悪もあり得るため,β遮断薬の単剤使用には十分な注意が必要である258).硝酸薬は心不全の症状や,血行動態改善効果が示されている259).長期予後の改善効果については明らかではないが260),狭心症治療薬としては第一に選択される薬剤である.短時間作用型のカルシウム拮抗薬は,収縮機能の低下した心不全症例で心不全症状の悪化と死亡リスクの増加をもたらすことが報告されており使用が避けられる傾向にある118),261),262).一方,長時間作用型のジヒドロピリジン系カルシウム拮抗薬は,顕性心不全患者の長期予後改善の効果は示されていないものの悪影響はないと考えられ,硝酸薬と共に狭心症治療薬として用いられる.我が国では,長期の心不全予防にも効果が期待されている258),263).これらの薬剤で狭心症に対する効果が不十分な場合には,ニコランジルの併用も行われる.一方,抗狭心症薬以外の心不全治療薬に関しては,ACE阻害薬や,ARBは心不全治療薬としての効果に加えて冠危険因子合併例での内皮機能改善効果が示されており,長期投与で虚血改善効果も期待され264),265),虚血性心疾患を伴う心不全患者での基礎薬としての使用が推奨される.
強心薬については心拍数の増加に伴う狭心症や心筋虚血の増悪,あるいは不整脈の誘発が危惧され冠動脈疾患合併心不全例では使用上注意を要する.
心筋梗塞に伴う心室性期外収縮,非持続性心室頻拍は致死性不整脈のトリガーとなり突然死を惹起する可能性が高い236).我が国の報告でもLVEFの低い症候
性慢性心不全の突然死の頻度は高いとされている266).
冠動脈疾患を合併した心不全
ClassⅠ
● 狭心症のある症例での硝酸薬(エビデンスレベルB)
● 冠攣縮性狭心症のない症例でのβ遮断薬(エビデンスレベルA)
● ACE阻害薬(エビデンスレベルA)
● ARB(エビデンスレベルA)
ClassⅡ a
● 十分な治療を行ってもNYHAⅡ度またはⅢ度の症状のあるLVEF 35%以下の症例におけるICD埋込み(エビデンスレベルA)
● 長時間作用型ジヒドロピリジン系カルシウム拮抗薬(エビデンスレベルB*注1)
*注1) 長時間作用型のジヒドロピリジン系カルシウム拮抗薬以外は心抑制作用のため使用を避けるべきと考えられている.
ClassⅢ
● 冠攣縮性狭心症のある症例でのβ遮断薬の単剤使用(エビデンスレベルB)
③ 腎機能低下例の治療
1)病態
慢性心不全症例において,腎機能低下は最も重要な予後規定因子であると同時に,腎不全症例特に透析症例においては心血管イベントが最も頻度の高い死亡原因である.このように,心臓病と腎臓病は密接な関係にあり,心腎連関の重要性が強調されている.また,次項で述べる貧血も心不全や腎不全に高率に合併することが明らかとなり,心腎連関を結びつける1 つの機序として貧血の存在にも注目され,心-腎-貧血症候群(Cardio-renal anemia syndrome)が提唱されている267),268).
2002年には米国National Kidney Foundationが,腎機能低下症例に対する実際的な臨床分類法として,慢性腎臓病(Chronic Kidney Disease: CKD)の概念を提唱した269),270).この基準は慢性腎機能障害の原因のいかんにかかわらず,蛋白尿や腎臓の形態変化,あるいは糸球体濾過量(GFR)が60 mL/min/1.73 m2 未満のいずれかが3 か月以上持続したものと定義された.我が国では腎臓病学会が2009年にイヌリンクリアランスをもとに邦人に適した推算式(estimated GFR:eGFR)を提唱した271).慢性心不全治療にもeGFRを求めて治療戦略を立てることが望まれる.
慢性心不全症例におけるCKDの割合はADHERE(Acute Decompensated Heart Failure National Registry)272)では,男性では60%以上,女性では90%以上と
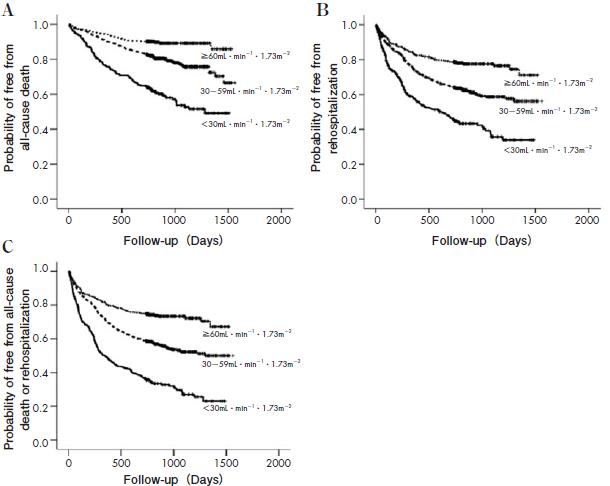
極めて頻度が高く,我が国からも,JCARE-CARD(Japanese Cardiac Registry and Heart Failure in Cardiology)では273)慢性心不全の症例の71%が,CHART(Chronic Heart Failure Analysis and Registry in the Tohoku District)274)でも42.7%がCKDを合併していた.さらに,心不全の予後がこれらeGFRによって層別化されることが確認された(図6)273).
2)治療
過去,慢性心不全を対象にした多くの大規模臨床試験が実施されているが,多くの研究では腎機能低下症例を除外している.腎機能の低下した慢性心不全症例のみを対象にした臨床試験は実施されておらず,腎機能低下症例でのサブ解析も残念ながら少ない.
利尿薬は慢性心不全の治療薬としてJCARE-CARDでは80%以上の症例に使用されており,ループ利尿薬はうっ血性心不全の治療には欠かせない薬剤である.ループ利尿薬は血清クレアチニン値が5.0 mg/dL程度までの腎機能低下ならば利尿効果は期待できるが,ループ利尿薬の過度な使用は腎機能を悪化させることが報告されているので, 過剰な使用には気をつけるべきである275),276).
慢性心不全の治療におけるACE阻害薬やARBの有効性は確立されている.CKDや尿蛋白を合併した高血圧や糖尿病性腎症等を対象にしたメタ解析でもACE阻害
薬やARBの心血管イベントの減少効果は報告されている277).しかし,腎機能低下合併慢性心不全のエビデンスは少ない.臨床の現場では,腎機能低下症例では
ACE阻害薬やARBによって惹起される血清クレアチニン値の上昇との狭間で,その使用を逡巡することもよく経験する.JCARE-CARDによると,臨床の現場ではACE阻害薬,ARBとも,腎機能低下を伴う心不全の30~ 50%で使用されている.eGFRの低下に伴い,ACE阻害薬はその使用頻度が減少するが,ARBは減少していない271).
ACE阻害薬やARBを用いた大規模臨床試験では,eGFRが30 mL/min/1.73m2 未満の症例はほとんど除外されている278).CONSENSUS 171)では血清クレアチニン値3.4 mg/dL以上を除外しているが,対象症例の平均の血清クレアチニン値は1.4 mg/dLであり,eGFRも平均45mL/min/1.73m2 で多くのCKD症例を含んでいる.血清クレアチニン値の平均値の上下で2 群に分けて検討したサブ解析によると,エナラプリルの効果は,血清クレアチニン値の低下群でも低下していない群と比べ同等であった.米国での腎機能障害を伴った心不全症例観察研究では,透析前の症例では,ACE阻害薬あるいはARBを投与されている症例のほうが,投与されていない症例と比べ生存率が高かった279).また,少数ではあるがCKDのステージ5(eGFR 15mL/min/1.73m2未満)で透析100症例と非透析43症例を対象に検討した結果,非透析の症例では,ACE阻害薬あるいはARBを処方されている症例のほうが,退院1 年後の生存率が有意に高かった.しかし,透析症例では,これら薬剤の処方の有無にかかわらず,予後に差がなかった279).
ACE阻害薬やARBを腎機能障害例に最初に投与するときには,少量より開始し,開始後1 週間以内に血清クレアチニン値を測定する.(1)前値と比べて30%以上の
上昇,(2)クレアチニン値が2.0 mg/dL未満の症例では0.5以上の上昇,(3)血清クレアチニン値が2.0 mg/dL以上の症例では1.0 mg/dL以上の上昇がないかを確認する.上記以上の上昇が認められた時には,減量して再度血清クレアチニン値を1週間以内に再検する.ACE阻害薬を使用するときには,腎代謝のものより肝代謝のもののほうが使いやすい.ARBはすべてが肝代謝である.
透析症例では,腎代謝性ACE阻害薬は,透析性を確かめる必要がある.ARBは透析でほとんど除去されないが,肝代謝であるので,用量を調節することなく使用することができる.また,PAN(polyacrylonitrile)透析膜を使用している症例では,ACE阻害薬はアナフィラキシーを起こすことがあるため使用禁忌であるが,ARBは使用可能である.
JCARE-CARDの報告では,β遮断薬は48%の症例に使用されており,eGFRが30 mL/min/1.73m2未満の症例でも44%の症例に投与されている273).米国の観察研究でもCKDのステージにかかわらず46~ 51%の症例に投与されている279).
ビソプロロールの有効性を検証したCIBISⅡのサブ解析では,eGFRが60 mL/min/1.73m2 以上の症例と,未満の症例で,ビソプロロールの効果に差がないことが報告され,ビソプロロールはCKD症例においても効果が期待できる161).また,カルベジロールの観察研究では,心不全の既往のない透析症例では,β遮断薬は新たな心不全の発症,心血管病による死亡率,全死亡率を有意に低下させたが,心不全の既往のある透析症例では,このような効果は認めなかった280).カルベジロールは,NYHAⅡ度もしくはⅢ度の拡張型心筋症を合併した透析患者を対象にした前向きランダム試験で予後を有意に改善することが示されている281).慢性心不全への使用にあたって注意することは,導入時の用量は一般に通常用量の1/10あるいはそれ以下より開始し,胸部レントゲン写真,臨床症状,血中BNP値等を参考に1~ 2 週間で漸増していく.
アルドステロン拮抗薬は,慢性心不全の治療薬として,その有用性がRALES 38)やEPHESUS 39)で報告されたが,これらの研究も血清クレアチニン値が2.5 mg/dL以上を除外している.eGFR 30~ 89 mL/min/1.73m2 の症例を対象に,スピロノラクトンの心肥大抑制効果を検討した112例の臨床試験では,腎機能の悪化あるいは高カリウム血症による脱落はそれぞれ1例ずつであった282).ACE阻害薬,またはARB併用症例では,特に高カリウム血症や腎機能の悪化に注意を払うべきである.
ジギタリスは,DIGでは血清クレアチニン値3.0 mg/dL以上は除外されているが,その範囲の症例ではジギタリスの効果はGFR値によって影響は受けなかった
283).腎不全症例では,中毒症の発現に留意すべきである.
高血圧も伴う慢性心不全症例では,高血圧治療ガイドラインでは130/80 mmHg未満にコントロールすることが勧められており,長時間作用型のカルシウム拮抗薬は
有効なことが多い.
腎機能低下を伴う心不全
ClassⅠ
● ACE阻害薬(透析症例を除く)(エビデンスレベルB)
● ARB(透析症例を除く)(エビデンスレベルB)
● β遮断薬(透析症例を除く)(エビデンスレベルA)
(透析症例)(エビデンスレベルB)
● 利尿薬(エビデンスレベルC)
ClassⅡ a
● アルドステロン拮抗薬(透析症例をのぞく)(エビデンスレベルB)
● ジギタリス(透析症例を除く)(エビデンスレベルB)
● カルシウム拮抗薬(高血圧合併例)(エビデンスレベルC)
ClassⅡb
● ACE阻害薬(透析症例)(エビデンスレベルB)
● ARB(透析症例)(エビデンスレベルB)
ClassⅢ
● 両側腎動脈狭窄がある場合のACE阻害薬,ARB使用
④ 糖尿病合併例の治療
1)病態
糖尿病は慢性心不全の強力な危険因子である.フラミンガム研究によれば,糖尿病症例での慢性心不全の発生頻度が対照と比べ,男性で2倍,女性で5倍高いと報告されている.また,多くの慢性心不全の大規模臨床試験では,糖尿病を合併している慢性心不全の頻度は増加しており,1989年では13%,1999年には47%まで増加している284).2009年に発表されたJCARE-CARD 273)では糖尿病の合併頻度は30.7%であった.CHARMのサブ解析では,糖尿病を合併していない症例と比べて,インスリン治療されている糖尿病症例では2 倍,インスリンで治療されていない症例では1.5倍,総死亡が高い285).
2)治療
糖尿病合併慢性心不全症例で,特に推薦される糖尿病治療法の確固たるエビデンスはない.チアゾリジン誘導体に関しては,心不全を悪化させるとの報告があり,心不全には慎重に使用すべきである.AHA-ADAのガイドラインではNYHAⅠ ~ Ⅱ 度では少量からの使用,NYHAⅢ~Ⅳ度では使用を避けるように勧告してい
る286).
慢性心不全で治療効果の確立しているACE阻害薬,ARB,β遮断薬の効果を,糖尿病を合併する心不全症例だけを対象にした臨床試験は報告されていない.ACE
阻害薬は過去の臨床試験からは平均23%慢性心不全症例の総死亡率を減少させることが期待できる.過去に報告された大規模試験のサブ解析によると,糖尿病を合併している症例と合併していない症例間で差は認められず,ACE阻害薬は糖尿病合併慢性心不全でも第一選択薬である287).ARBもCHARMで糖尿病の合併の有無にかかわらず同等の効果が報告されている177),181).
β遮断薬は,これまでの大規模臨床試験で30~ 40%の死亡率の低下が望める.糖尿病を合併している症例でも,合併していない症例と比べて,少し効果は落ちる
ものの,統計的には同等の効果が期待できる286).β遮断薬は,血糖を悪化させる,あるいは低血糖症状をマスクするとの危惧より,使用を躊躇することがあるが,この死亡率抑制効果を考慮すると,糖尿病合併の症候性慢性心不全の治療にβ遮断薬の使用を中止すべきではないと米国心不全学会は勧告している288).β遮断薬の糖代謝に及ぼす効果は,すべてで同等ではない.心不全ではなく高血圧症を対象にした研究ではあるが,カルベジロールと酒石酸メトプロロールとの糖代謝への効果を解析した研究によると,カルベジロール群ではインスリン感受性が改善し,微量アルブミン尿が減少したとの報告もある289).
糖尿病を合併した心不全への薬物療法
ClassⅠ
● ACE阻害薬(エビデンスレベルA)
● ARB(エビデンスレベルA)
● β遮断薬(エビデンスレベルA)
● 利尿薬(エビデンスレベルC)
ClassⅡ a
● アルドステロン拮抗薬(エビデンスレベルC)
⑤ 貧血合併例の治療
1)病態
慢性心不全症例には貧血が多くの割合で認められ,JCARE-CARD 290)では,56.7%の症例で合併している.貧血は,総死亡,心臓死,心不全の悪化による再入院に対する独立した危険因子であることが確認された.総死亡,あるいは再入院に対する相対危険度は血清ヘモグロブン値13.7 g/dL以上のグループを1とすると,12.0~13.6 g/dLで1.71,10.1 ~ 11.9 g/dLで2.09,10.1 g/dL未満で2.61であった.JCARE-CARDの結果は,欧米の報告291)と比べ貧血の割合が高いが,これは定義,対象年齢等の違いによる可能性がある.
慢性心不全で観察される貧血の原因は,合併するCKDに起因するエリスロポエチンの低下,心不全に伴うTNF-α等のサイトカインによる骨髄での産生低下等が考えられるが,鉄欠乏性貧血,悪性腫瘍の合併との鑑別診断を行い,否定されれば心不全に伴う貧血と判断すべきである.
2)治療
このように貧血は慢性心不全の独立した予後規定因子であるが,貧血をいかに治療するかに関してはまだ確立したエビデンスがない.2000年にSilverbergら268)によってエリスロポエチンの皮下投与と鉄剤の静脈内投与の有用性が報告された.その後いくつかのESP(erythropoiesis stimulating protein)による報告があるが大規模臨床試験はまだない.慢性心不全319例を対象にした臨床試験では,ESPとしてダルポエチンαを2週ごとに0.75 μg/kg皮下注射を行う群とプラセボ群に割り付け
1年間治療を行った.血清ヘモグロビン値は,中央値で投与前11.3 g/dLから13.4 g/dLに改善したが,ESP治療にて運動耐容能,NYHA重症度分類,QOLも有意には改善させなかった.しかし,血清ヘモグロビン値が2.0 g/dL以上改善した症例では,運動時間が有意に延長していたと報告していた292).ESPを心不全治療に試みた過去の7 編の論文のメタ解析では,ESP治療は心不全による再入院を有意に減少させたが(risk ratio= 0.59; 95%CI 0.41 ~ 0.86; p= 0.006),死亡率を有意に減少させることはできなかった(risk ratio= 0.69; 95%CI 0.39 ~1.23; p= 0.21).しかし,ESP治療によって危惧されていた高血圧の出現あるいは血栓症の頻度にはコントロール群と比べ有意な差は認められなかった293).
貧血を伴う心不全
ClassⅡb
● エリスロポエチン(エビデンスレベルB)
1)病態
病態の進行した心不全患者では血圧が低下した症例が多いが,高血圧を合併する症例では心機能改善・病態進行抑制のために,心不全に対する一般的な治療法に加えて高血圧治療が重要になる.高血圧は,収縮期・拡張期の圧負荷の増大によって左室の収縮・拡張機能に障害をもたらす246).高血圧は,左室リモデリングを促進し,壁ストレス増大による酸素消費量増加,微小循環障害や冠動脈内皮障害による心筋虚血によって心筋障害を進展させる.心不全患者の急性期と慢性期の予後改善にとって,高血圧の適正な管理は極めて重要である.我が国の疫学研究によって,高血圧は心不全の基礎疾患として冠動脈疾患や拡張型心筋症と共に頻度が高いことが示されている247),248).また,大規模臨床試験の成績では,降圧治療により,高血圧患者における心不全発症率が減少することが明らかにされている249)-251).
2)治療
高血圧治療ガイドライン2009(日本高血圧学会)では,心血管病を有する高血圧患者は高リスク群に分類され,生活習慣是正と降圧薬治療をただちに開始することを薦めている252).薬剤選択に関しては,降圧をはかりつつ心不全の治療を行うことが原則となる.我が国を含む多くの大規模臨床試験で,ACE阻害薬,およびARBと
β遮断薬は心不全患者の長期予後を改善することが明らかにされている171),173),176)-181),212).したがって,心不全を合併する高血圧には,ACE阻害薬,ARB,β遮断薬の単独ないし併用が良い適応になる.降圧効果が不十分な場合や,臓器うっ血を伴う心不全では利尿薬が使用され,十分な降圧が得られる場合心不全発症を有意に抑制する250).さらに降圧が必要である場合は,アルドステロン拮抗薬であるスピロノラクトンやエプレレノンの使用が推薦され,予後改善効果38),39)も示されている.長時間作用型のジヒドロピリジン系カルシウム拮抗薬は,心不全患者の予後を増悪させないことが明らかにされており,安全に使用することができると考えられる200).収縮能が保持された心不全の治療エビデンスは不十分であるが,十分な血圧管理が必須と考えられている.高血圧を合併した心不全患者の降圧目標値は症例によって異なると思われるが,130/80 mmHg未満とする報告が多い118),253).降圧目標を達成した後は,過度の低血圧を来たさない限り,予後改善を目的とする心不全加療を十分に施行することが重要である.
高血圧を合併した収縮能が低下した心不全に対する治療
ClassⅠ
● ACE阻害薬(エビデンスレベルA)
● ARB(エビデンスレベルA)
● β遮断薬(エビデンスレベルA)
● 利尿薬(エビデンスレベルB)
● アルドステロン拮抗薬(エビデンスレベルB)
ClassⅡ a
● カルシウム拮抗薬(注1,エビデンスレベルB)
(注1) 長時間作用型のジヒドロピリジン系カルシウム拮抗薬以外は心抑制作用のため使用を避けるべきと考えられている.
高血圧を合併した収縮能が保持された心不全に対する治療
ClassⅡ a
● ACE阻害薬(エビデンスレベルC)
● ARB(エビデンスレベルC)
② 冠動脈疾患合併例の治療
1)病態
心不全の背景疾患として冠動脈疾患は,高血圧や拡張型心筋症とともに頻度が高い248).心筋虚血は,収縮機能と拡張機能の双方を障害し,心筋梗塞による心筋傷害は心室機能不全の原因となる.心不全に狭心症を合併すると,運動耐容能はさらに低下し,心筋虚血は心不全を増悪させる.また心不全は心筋虚血を増強して悪循環を形成する.我が国の報告では,虚血性心疾患を背景とする心不全患者の予後は,非虚血性心疾患を背景とする症例に比べて不良であった253).冠動脈疾患を合併した心不全患者の治療においては,狭心症の存在によって低下したQOLと心筋虚血や心筋傷害によって惹起された心機能低下の両面に対する対策が必要である.
2)治療
非薬物治療であるが,冠動脈疾患を合併した心不全症例における狭心症治療・血行再建の効果については確立したエビデンスが存在しない.しかし,経皮的冠動脈インターベンション(PCI)や冠動脈バイパス術による心機能の回復効果は十分に期待され254),255),狭心症症状を示す症例や,虚血が心機能低下の原因と証明された症例では,よく検討した上で選択されるべき治療法である256),257).
薬物治療を行うにあたっては,(1)心筋虚血,(2)心不全,(3)冠危険因子を含めた二次予防への効果を考慮して選択する.β遮断薬は左心室駆出率の低下した心不全症例において症状や,血行動態を改善し,再梗塞と死亡リスクを軽減する161),182),183),186).心不全増悪を配慮して少量より開始されるため,狭心症を有する症例で狭心症治療効果が不十分な場合は他の抗狭心症薬を併用する.また,冠攣縮性狭心症合併例では,増悪もあり得るため,β遮断薬の単剤使用には十分な注意が必要である258).硝酸薬は心不全の症状や,血行動態改善効果が示されている259).長期予後の改善効果については明らかではないが260),狭心症治療薬としては第一に選択される薬剤である.短時間作用型のカルシウム拮抗薬は,収縮機能の低下した心不全症例で心不全症状の悪化と死亡リスクの増加をもたらすことが報告されており使用が避けられる傾向にある118),261),262).一方,長時間作用型のジヒドロピリジン系カルシウム拮抗薬は,顕性心不全患者の長期予後改善の効果は示されていないものの悪影響はないと考えられ,硝酸薬と共に狭心症治療薬として用いられる.我が国では,長期の心不全予防にも効果が期待されている258),263).これらの薬剤で狭心症に対する効果が不十分な場合には,ニコランジルの併用も行われる.一方,抗狭心症薬以外の心不全治療薬に関しては,ACE阻害薬や,ARBは心不全治療薬としての効果に加えて冠危険因子合併例での内皮機能改善効果が示されており,長期投与で虚血改善効果も期待され264),265),虚血性心疾患を伴う心不全患者での基礎薬としての使用が推奨される.
強心薬については心拍数の増加に伴う狭心症や心筋虚血の増悪,あるいは不整脈の誘発が危惧され冠動脈疾患合併心不全例では使用上注意を要する.
心筋梗塞に伴う心室性期外収縮,非持続性心室頻拍は致死性不整脈のトリガーとなり突然死を惹起する可能性が高い236).我が国の報告でもLVEFの低い症候
性慢性心不全の突然死の頻度は高いとされている266).
冠動脈疾患を合併した心不全
ClassⅠ
● 狭心症のある症例での硝酸薬(エビデンスレベルB)
● 冠攣縮性狭心症のない症例でのβ遮断薬(エビデンスレベルA)
● ACE阻害薬(エビデンスレベルA)
● ARB(エビデンスレベルA)
ClassⅡ a
● 十分な治療を行ってもNYHAⅡ度またはⅢ度の症状のあるLVEF 35%以下の症例におけるICD埋込み(エビデンスレベルA)
● 長時間作用型ジヒドロピリジン系カルシウム拮抗薬(エビデンスレベルB*注1)
*注1) 長時間作用型のジヒドロピリジン系カルシウム拮抗薬以外は心抑制作用のため使用を避けるべきと考えられている.
ClassⅢ
● 冠攣縮性狭心症のある症例でのβ遮断薬の単剤使用(エビデンスレベルB)
③ 腎機能低下例の治療
1)病態
慢性心不全症例において,腎機能低下は最も重要な予後規定因子であると同時に,腎不全症例特に透析症例においては心血管イベントが最も頻度の高い死亡原因である.このように,心臓病と腎臓病は密接な関係にあり,心腎連関の重要性が強調されている.また,次項で述べる貧血も心不全や腎不全に高率に合併することが明らかとなり,心腎連関を結びつける1 つの機序として貧血の存在にも注目され,心-腎-貧血症候群(Cardio-renal anemia syndrome)が提唱されている267),268).
2002年には米国National Kidney Foundationが,腎機能低下症例に対する実際的な臨床分類法として,慢性腎臓病(Chronic Kidney Disease: CKD)の概念を提唱した269),270).この基準は慢性腎機能障害の原因のいかんにかかわらず,蛋白尿や腎臓の形態変化,あるいは糸球体濾過量(GFR)が60 mL/min/1.73 m2 未満のいずれかが3 か月以上持続したものと定義された.我が国では腎臓病学会が2009年にイヌリンクリアランスをもとに邦人に適した推算式(estimated GFR:eGFR)を提唱した271).慢性心不全治療にもeGFRを求めて治療戦略を立てることが望まれる.
慢性心不全症例におけるCKDの割合はADHERE(Acute Decompensated Heart Failure National Registry)272)では,男性では60%以上,女性では90%以上と
極めて頻度が高く,我が国からも,JCARE-CARD(Japanese Cardiac Registry and Heart Failure in Cardiology)では273)慢性心不全の症例の71%が,CHART(Chronic Heart Failure Analysis and Registry in the Tohoku District)274)でも42.7%がCKDを合併していた.さらに,心不全の予後がこれらeGFRによって層別化されることが確認された(図6)273).
2)治療
過去,慢性心不全を対象にした多くの大規模臨床試験が実施されているが,多くの研究では腎機能低下症例を除外している.腎機能の低下した慢性心不全症例のみを対象にした臨床試験は実施されておらず,腎機能低下症例でのサブ解析も残念ながら少ない.
利尿薬は慢性心不全の治療薬としてJCARE-CARDでは80%以上の症例に使用されており,ループ利尿薬はうっ血性心不全の治療には欠かせない薬剤である.ループ利尿薬は血清クレアチニン値が5.0 mg/dL程度までの腎機能低下ならば利尿効果は期待できるが,ループ利尿薬の過度な使用は腎機能を悪化させることが報告されているので, 過剰な使用には気をつけるべきである275),276).
慢性心不全の治療におけるACE阻害薬やARBの有効性は確立されている.CKDや尿蛋白を合併した高血圧や糖尿病性腎症等を対象にしたメタ解析でもACE阻害
薬やARBの心血管イベントの減少効果は報告されている277).しかし,腎機能低下合併慢性心不全のエビデンスは少ない.臨床の現場では,腎機能低下症例では
ACE阻害薬やARBによって惹起される血清クレアチニン値の上昇との狭間で,その使用を逡巡することもよく経験する.JCARE-CARDによると,臨床の現場ではACE阻害薬,ARBとも,腎機能低下を伴う心不全の30~ 50%で使用されている.eGFRの低下に伴い,ACE阻害薬はその使用頻度が減少するが,ARBは減少していない271).
ACE阻害薬やARBを用いた大規模臨床試験では,eGFRが30 mL/min/1.73m2 未満の症例はほとんど除外されている278).CONSENSUS 171)では血清クレアチニン値3.4 mg/dL以上を除外しているが,対象症例の平均の血清クレアチニン値は1.4 mg/dLであり,eGFRも平均45mL/min/1.73m2 で多くのCKD症例を含んでいる.血清クレアチニン値の平均値の上下で2 群に分けて検討したサブ解析によると,エナラプリルの効果は,血清クレアチニン値の低下群でも低下していない群と比べ同等であった.米国での腎機能障害を伴った心不全症例観察研究では,透析前の症例では,ACE阻害薬あるいはARBを投与されている症例のほうが,投与されていない症例と比べ生存率が高かった279).また,少数ではあるがCKDのステージ5(eGFR 15mL/min/1.73m2未満)で透析100症例と非透析43症例を対象に検討した結果,非透析の症例では,ACE阻害薬あるいはARBを処方されている症例のほうが,退院1 年後の生存率が有意に高かった.しかし,透析症例では,これら薬剤の処方の有無にかかわらず,予後に差がなかった279).
ACE阻害薬やARBを腎機能障害例に最初に投与するときには,少量より開始し,開始後1 週間以内に血清クレアチニン値を測定する.(1)前値と比べて30%以上の
上昇,(2)クレアチニン値が2.0 mg/dL未満の症例では0.5以上の上昇,(3)血清クレアチニン値が2.0 mg/dL以上の症例では1.0 mg/dL以上の上昇がないかを確認する.上記以上の上昇が認められた時には,減量して再度血清クレアチニン値を1週間以内に再検する.ACE阻害薬を使用するときには,腎代謝のものより肝代謝のもののほうが使いやすい.ARBはすべてが肝代謝である.
透析症例では,腎代謝性ACE阻害薬は,透析性を確かめる必要がある.ARBは透析でほとんど除去されないが,肝代謝であるので,用量を調節することなく使用することができる.また,PAN(polyacrylonitrile)透析膜を使用している症例では,ACE阻害薬はアナフィラキシーを起こすことがあるため使用禁忌であるが,ARBは使用可能である.
JCARE-CARDの報告では,β遮断薬は48%の症例に使用されており,eGFRが30 mL/min/1.73m2未満の症例でも44%の症例に投与されている273).米国の観察研究でもCKDのステージにかかわらず46~ 51%の症例に投与されている279).
ビソプロロールの有効性を検証したCIBISⅡのサブ解析では,eGFRが60 mL/min/1.73m2 以上の症例と,未満の症例で,ビソプロロールの効果に差がないことが報告され,ビソプロロールはCKD症例においても効果が期待できる161).また,カルベジロールの観察研究では,心不全の既往のない透析症例では,β遮断薬は新たな心不全の発症,心血管病による死亡率,全死亡率を有意に低下させたが,心不全の既往のある透析症例では,このような効果は認めなかった280).カルベジロールは,NYHAⅡ度もしくはⅢ度の拡張型心筋症を合併した透析患者を対象にした前向きランダム試験で予後を有意に改善することが示されている281).慢性心不全への使用にあたって注意することは,導入時の用量は一般に通常用量の1/10あるいはそれ以下より開始し,胸部レントゲン写真,臨床症状,血中BNP値等を参考に1~ 2 週間で漸増していく.
アルドステロン拮抗薬は,慢性心不全の治療薬として,その有用性がRALES 38)やEPHESUS 39)で報告されたが,これらの研究も血清クレアチニン値が2.5 mg/dL以上を除外している.eGFR 30~ 89 mL/min/1.73m2 の症例を対象に,スピロノラクトンの心肥大抑制効果を検討した112例の臨床試験では,腎機能の悪化あるいは高カリウム血症による脱落はそれぞれ1例ずつであった282).ACE阻害薬,またはARB併用症例では,特に高カリウム血症や腎機能の悪化に注意を払うべきである.
ジギタリスは,DIGでは血清クレアチニン値3.0 mg/dL以上は除外されているが,その範囲の症例ではジギタリスの効果はGFR値によって影響は受けなかった
283).腎不全症例では,中毒症の発現に留意すべきである.
高血圧も伴う慢性心不全症例では,高血圧治療ガイドラインでは130/80 mmHg未満にコントロールすることが勧められており,長時間作用型のカルシウム拮抗薬は
有効なことが多い.
腎機能低下を伴う心不全
ClassⅠ
● ACE阻害薬(透析症例を除く)(エビデンスレベルB)
● ARB(透析症例を除く)(エビデンスレベルB)
● β遮断薬(透析症例を除く)(エビデンスレベルA)
(透析症例)(エビデンスレベルB)
● 利尿薬(エビデンスレベルC)
ClassⅡ a
● アルドステロン拮抗薬(透析症例をのぞく)(エビデンスレベルB)
● ジギタリス(透析症例を除く)(エビデンスレベルB)
● カルシウム拮抗薬(高血圧合併例)(エビデンスレベルC)
ClassⅡb
● ACE阻害薬(透析症例)(エビデンスレベルB)
● ARB(透析症例)(エビデンスレベルB)
ClassⅢ
● 両側腎動脈狭窄がある場合のACE阻害薬,ARB使用
④ 糖尿病合併例の治療
1)病態
糖尿病は慢性心不全の強力な危険因子である.フラミンガム研究によれば,糖尿病症例での慢性心不全の発生頻度が対照と比べ,男性で2倍,女性で5倍高いと報告されている.また,多くの慢性心不全の大規模臨床試験では,糖尿病を合併している慢性心不全の頻度は増加しており,1989年では13%,1999年には47%まで増加している284).2009年に発表されたJCARE-CARD 273)では糖尿病の合併頻度は30.7%であった.CHARMのサブ解析では,糖尿病を合併していない症例と比べて,インスリン治療されている糖尿病症例では2 倍,インスリンで治療されていない症例では1.5倍,総死亡が高い285).
2)治療
糖尿病合併慢性心不全症例で,特に推薦される糖尿病治療法の確固たるエビデンスはない.チアゾリジン誘導体に関しては,心不全を悪化させるとの報告があり,心不全には慎重に使用すべきである.AHA-ADAのガイドラインではNYHAⅠ ~ Ⅱ 度では少量からの使用,NYHAⅢ~Ⅳ度では使用を避けるように勧告してい
る286).
慢性心不全で治療効果の確立しているACE阻害薬,ARB,β遮断薬の効果を,糖尿病を合併する心不全症例だけを対象にした臨床試験は報告されていない.ACE
阻害薬は過去の臨床試験からは平均23%慢性心不全症例の総死亡率を減少させることが期待できる.過去に報告された大規模試験のサブ解析によると,糖尿病を合併している症例と合併していない症例間で差は認められず,ACE阻害薬は糖尿病合併慢性心不全でも第一選択薬である287).ARBもCHARMで糖尿病の合併の有無にかかわらず同等の効果が報告されている177),181).
β遮断薬は,これまでの大規模臨床試験で30~ 40%の死亡率の低下が望める.糖尿病を合併している症例でも,合併していない症例と比べて,少し効果は落ちる
ものの,統計的には同等の効果が期待できる286).β遮断薬は,血糖を悪化させる,あるいは低血糖症状をマスクするとの危惧より,使用を躊躇することがあるが,この死亡率抑制効果を考慮すると,糖尿病合併の症候性慢性心不全の治療にβ遮断薬の使用を中止すべきではないと米国心不全学会は勧告している288).β遮断薬の糖代謝に及ぼす効果は,すべてで同等ではない.心不全ではなく高血圧症を対象にした研究ではあるが,カルベジロールと酒石酸メトプロロールとの糖代謝への効果を解析した研究によると,カルベジロール群ではインスリン感受性が改善し,微量アルブミン尿が減少したとの報告もある289).
糖尿病を合併した心不全への薬物療法
ClassⅠ
● ACE阻害薬(エビデンスレベルA)
● ARB(エビデンスレベルA)
● β遮断薬(エビデンスレベルA)
● 利尿薬(エビデンスレベルC)
ClassⅡ a
● アルドステロン拮抗薬(エビデンスレベルC)
⑤ 貧血合併例の治療
1)病態
慢性心不全症例には貧血が多くの割合で認められ,JCARE-CARD 290)では,56.7%の症例で合併している.貧血は,総死亡,心臓死,心不全の悪化による再入院に対する独立した危険因子であることが確認された.総死亡,あるいは再入院に対する相対危険度は血清ヘモグロブン値13.7 g/dL以上のグループを1とすると,12.0~13.6 g/dLで1.71,10.1 ~ 11.9 g/dLで2.09,10.1 g/dL未満で2.61であった.JCARE-CARDの結果は,欧米の報告291)と比べ貧血の割合が高いが,これは定義,対象年齢等の違いによる可能性がある.
慢性心不全で観察される貧血の原因は,合併するCKDに起因するエリスロポエチンの低下,心不全に伴うTNF-α等のサイトカインによる骨髄での産生低下等が考えられるが,鉄欠乏性貧血,悪性腫瘍の合併との鑑別診断を行い,否定されれば心不全に伴う貧血と判断すべきである.
2)治療
このように貧血は慢性心不全の独立した予後規定因子であるが,貧血をいかに治療するかに関してはまだ確立したエビデンスがない.2000年にSilverbergら268)によってエリスロポエチンの皮下投与と鉄剤の静脈内投与の有用性が報告された.その後いくつかのESP(erythropoiesis stimulating protein)による報告があるが大規模臨床試験はまだない.慢性心不全319例を対象にした臨床試験では,ESPとしてダルポエチンαを2週ごとに0.75 μg/kg皮下注射を行う群とプラセボ群に割り付け
1年間治療を行った.血清ヘモグロビン値は,中央値で投与前11.3 g/dLから13.4 g/dLに改善したが,ESP治療にて運動耐容能,NYHA重症度分類,QOLも有意には改善させなかった.しかし,血清ヘモグロビン値が2.0 g/dL以上改善した症例では,運動時間が有意に延長していたと報告していた292).ESPを心不全治療に試みた過去の7 編の論文のメタ解析では,ESP治療は心不全による再入院を有意に減少させたが(risk ratio= 0.59; 95%CI 0.41 ~ 0.86; p= 0.006),死亡率を有意に減少させることはできなかった(risk ratio= 0.69; 95%CI 0.39 ~1.23; p= 0.21).しかし,ESP治療によって危惧されていた高血圧の出現あるいは血栓症の頻度にはコントロール群と比べ有意な差は認められなかった293).
貧血を伴う心不全
ClassⅡb
● エリスロポエチン(エビデンスレベルB)
図6 腎機能障害を合併した心不全の生命予後(文献274より引用)
Ⅱ 慢性心不全の治療 >
2 薬物療法 >
4 合併症を有する患者での心不全治療
慢性心不全治療ガイドライン(2010年改訂版)
Guidelines for Treatment of Chronic Heart Failure(JCS 2010)
Guidelines for Treatment of Chronic Heart Failure(JCS 2010)