

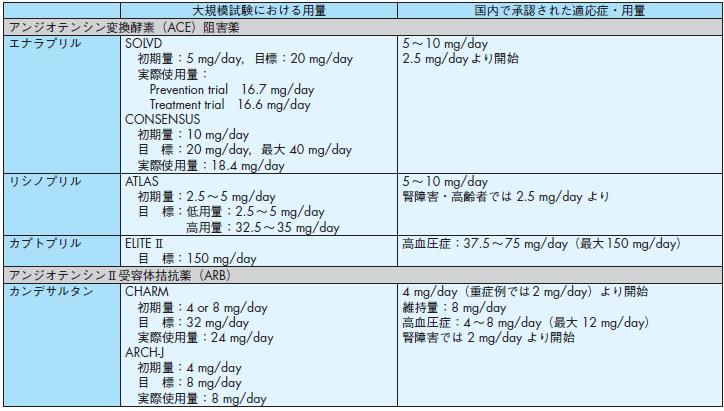
大規模試験における用量国内で承認された適応症・用量
アンジオテンシン変換酵素(ACE)阻害薬
エナラプリルSOLVD
初期量:5 mg/day,目標:20 mg/day
実際使用量:
Prevention trial 16.7 mg/day
Treatment trial 16.6 mg/day
CONSENSUS
初期量:10 mg/day
目標:20 mg/day,最大 40 mg/day
実際使用量:18.4 mg/day
5~10 mg/day
2.5 mg/day より開始
リシノプリルATLAS
初期量:2.5~5 mg/day
目標:低用量:2.5~5 mg/day 高用量:32.5~35 mg/day
5~10 mg/day
腎障害・高齢者では 2.5 mg/day より
カプトプリルELITEⅡ
目標:150 mg/day
高血圧症:37.5~75 mg/day(最大150 mg/day)
アンジオテンシンⅡ受容体拮抗薬(ARB)
カンデサルタンCHARM
初期量:4 or 8 mg/day 目標:32 mg/day 実際使用量:24 mg/day
ARCH-J
初期量:4 mg/day 目標:8 mg/day 実際使用量: 8 mg/day
4 mg/day(重症例では2 mg/day)より開始
維持量:8 mg/day
高血圧症:4~8 mg/day(最大 12 mg/day)
腎障害では 2 mg/day より開始
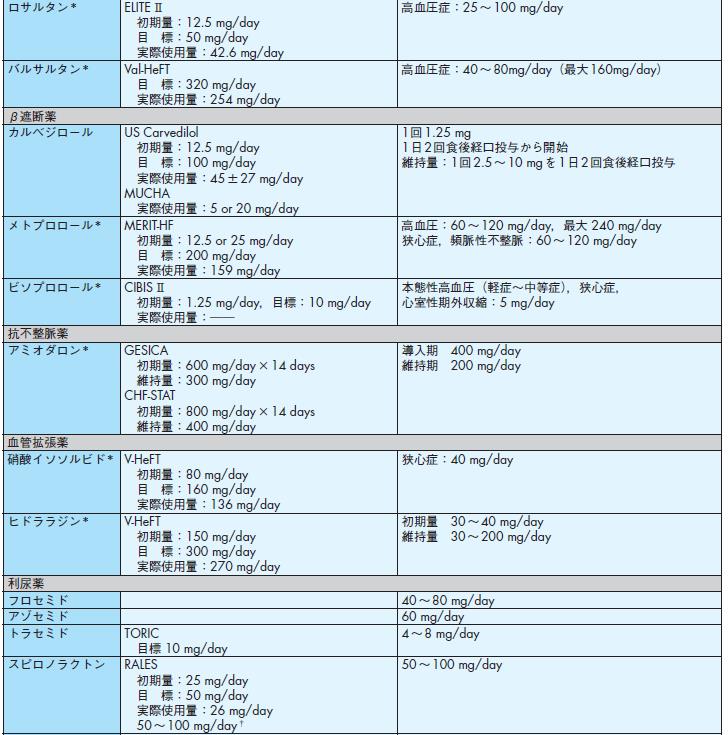
ロサルタン* ELITEⅡ
初期量:12.5 mg/day 目標:50 mg/day 実際使用量:42.6 mg/day
高血圧症:25~100 mg/day
バルサルタン* Val-HeFT
目標:320 mg/day 実際使用量:254 mg/day
高血圧症:40~80mg/day(最大160mg/day)
β遮断薬
カルベジロールUS Carvedilol
初期量:12.5 mg/day 目標:100 mg/day 実際使用量:45±27 mg/day
MUCHA
実際使用量:5 or 20 mg/day
1回1.25 mg
1日2回食後経口投与から開始
維持量:1回2.5~10 mgを1日2回食後経口投与
メトプロロール* MERIT-HF
初期量:12.5 or 25 mg/day
目 標:200 mg/day
実際使用量:159 mg/day
高血圧:60~120 mg/day,最大 240 mg/day
狭心症,頻脈性不整脈:60~120 mg/day
ビソプロロール* CIBISⅡ
初期量:1.25 mg/day,目標:10 mg/day
実際使用量:――
本態性高血圧(軽症~中等症),狭心症,
心室性期外収縮:5 mg/day
抗不整脈薬
アミオダロン* GESICA
初期量:600 mg/day×14 days
維持量:300 mg/day
CHF-STAT
初期量:800 mg/day×14 days
維持量:400 mg/day
導入期 400 mg/day
維持期 200 mg/day
血管拡張薬
硝酸イソソルビド* V-HeFT
初期量:80 mg/day
目 標:160 mg/day
実際使用量:136 mg/day
狭心症:40 mg/day
ヒドララジン* V-HeFT
初期量:150 mg/day 目標:300 mg/day 実際使用量:270 mg/day
初期量 30~40 mg/day
維持量 30~200 mg/day
利尿薬
フロセミド40~80 mg/day
アゾセミド60 mg/day
トラセミドTORIC
目標 10 mg/day 4~8 mg/day
スピロノラクトンRALES
初期量:25 mg/day 目標:50 mg/day 実際使用量:26 mg/day
50~100 mg/day†
50~100 mg/day
エプレレノン* EPHESUS
初期量:25 mg/day 目標:50 mg/day 実際使用量:43 mg/day
ジギタリス製剤
ジゴキシン年齢,性別,体重,腎機能を考慮したアルゴリズム**を用い初期量を決定
維持量 0.125~0.25 mg/day
経口強心薬
ピモベンダンEPOCH
実際使用量:2.5 or 5.0 mg/day 2.5~5.0 mg/day,1日2回に分け投与.
アンジオテンシン変換酵素(ACE)阻害薬
エナラプリルSOLVD
初期量:5 mg/day,目標:20 mg/day
実際使用量:
Prevention trial 16.7 mg/day
Treatment trial 16.6 mg/day
CONSENSUS
初期量:10 mg/day
目標:20 mg/day,最大 40 mg/day
実際使用量:18.4 mg/day
5~10 mg/day
2.5 mg/day より開始
リシノプリルATLAS
初期量:2.5~5 mg/day
目標:低用量:2.5~5 mg/day 高用量:32.5~35 mg/day
5~10 mg/day
腎障害・高齢者では 2.5 mg/day より
カプトプリルELITEⅡ
目標:150 mg/day
高血圧症:37.5~75 mg/day(最大150 mg/day)
アンジオテンシンⅡ受容体拮抗薬(ARB)
カンデサルタンCHARM
初期量:4 or 8 mg/day 目標:32 mg/day 実際使用量:24 mg/day
ARCH-J
初期量:4 mg/day 目標:8 mg/day 実際使用量: 8 mg/day
4 mg/day(重症例では2 mg/day)より開始
維持量:8 mg/day
高血圧症:4~8 mg/day(最大 12 mg/day)
腎障害では 2 mg/day より開始
ロサルタン* ELITEⅡ
初期量:12.5 mg/day 目標:50 mg/day 実際使用量:42.6 mg/day
高血圧症:25~100 mg/day
バルサルタン* Val-HeFT
目標:320 mg/day 実際使用量:254 mg/day
高血圧症:40~80mg/day(最大160mg/day)
β遮断薬
カルベジロールUS Carvedilol
初期量:12.5 mg/day 目標:100 mg/day 実際使用量:45±27 mg/day
MUCHA
実際使用量:5 or 20 mg/day
1回1.25 mg
1日2回食後経口投与から開始
維持量:1回2.5~10 mgを1日2回食後経口投与
メトプロロール* MERIT-HF
初期量:12.5 or 25 mg/day
目 標:200 mg/day
実際使用量:159 mg/day
高血圧:60~120 mg/day,最大 240 mg/day
狭心症,頻脈性不整脈:60~120 mg/day
ビソプロロール* CIBISⅡ
初期量:1.25 mg/day,目標:10 mg/day
実際使用量:――
本態性高血圧(軽症~中等症),狭心症,
心室性期外収縮:5 mg/day
抗不整脈薬
アミオダロン* GESICA
初期量:600 mg/day×14 days
維持量:300 mg/day
CHF-STAT
初期量:800 mg/day×14 days
維持量:400 mg/day
導入期 400 mg/day
維持期 200 mg/day
血管拡張薬
硝酸イソソルビド* V-HeFT
初期量:80 mg/day
目 標:160 mg/day
実際使用量:136 mg/day
狭心症:40 mg/day
ヒドララジン* V-HeFT
初期量:150 mg/day 目標:300 mg/day 実際使用量:270 mg/day
初期量 30~40 mg/day
維持量 30~200 mg/day
利尿薬
フロセミド40~80 mg/day
アゾセミド60 mg/day
トラセミドTORIC
目標 10 mg/day 4~8 mg/day
スピロノラクトンRALES
初期量:25 mg/day 目標:50 mg/day 実際使用量:26 mg/day
50~100 mg/day†
50~100 mg/day
エプレレノン* EPHESUS
初期量:25 mg/day 目標:50 mg/day 実際使用量:43 mg/day
ジギタリス製剤
ジゴキシン年齢,性別,体重,腎機能を考慮したアルゴリズム**を用い初期量を決定
維持量 0.125~0.25 mg/day
経口強心薬
ピモベンダンEPOCH
実際使用量:2.5 or 5.0 mg/day 2.5~5.0 mg/day,1日2回に分け投与.
抗アルドステロン薬
ACE 阻害薬
ARB
β遮断薬
利尿薬
ジギタリス
経口強心薬
静注強心薬
h-ANP
難治性
NYHA 分類
無症候性軽症中等症~
重症AHA/ACC
Stage 分類
ACE 阻害薬
ARB
β遮断薬
利尿薬
ジギタリス
経口強心薬
静注強心薬
h-ANP
難治性
NYHA 分類
無症候性軽症中等症~
重症AHA/ACC
Stage 分類
心不全の大半は左室収縮機能不全に基づく心不全である.特にその原因としては非虚血性の拡張型心筋症と,いわゆる虚血性心筋症に大別できる.これらの疾患においては交感神経系,RAA系が賦活化され,進行性の左室拡大と収縮性の低下,すなわちリモデリングが生じ,死亡,心不全の悪化等のイベントにつながると考えられている.したがって,このような神経内分泌系を阻害することにより左室リモデリングを抑制し,心不全の予後を改善することが最近の慢性心不全治療の中心と
なっている.ここではこのような世界的傾向をふまえた上で,我が国の事情に即した薬物治療のガイドラインを提供することを目標とした.抗凝固薬,アミオダロン以外の抗不整脈薬については他の項を,また収縮機能障害による慢性心不全の急性増悪時の治療は「急性重症心不全治療ガイドライン」を参照されたい.
① ジギタリス
1997年にDIGの結果が発表され,ジゴキシンが洞調律心不全患者の心不全増悪による入院を減らすことが明らかとなったが予後は改善しなかった162). DIGのサ
ブスタディーではジゴキシン血中濃度に比例して死亡率が増加することが明らかにされており,LVEF 45%以下の洞調律の心不全患者の至適血中濃度として,0.5~ 0.8ng/mLが提案されている166).
DIG 162)ではジゴキシンが不整脈に関連した死亡をむしろ増加させる傾向にある.またDIGの別のサブスタディーでは,ジゴキシンは女性心不全患者においてはむ
しろ予後を悪化させるというエビデンスも得られている167)のでこれらの患者群における使用は注意を要する.
一方,心房細動を伴う心不全患者においては,心拍数をコントロールし十分な左室充満時間を得るためにジギタリスが用いられる.これは臨床症状の改善を目的と
するものであって,心房細動を伴う左室収縮機能不全患者においてジギタリスが予後を改善するかどうかに関するエビデンスはない.また左室収縮機能低下に基づく
心不全患者の心房細動のレートコントロールにジギタリスが最適であるかどうかについてもエビデンスも得られていない.
ジゴキシン以外のジギタリス製剤が心不全のコントロールにおいてジゴキシンよりも優れているという明らかなエビデンスは得られていない.
② 利尿薬
心不全患者のうっ血に基づく労作時呼吸困難,浮腫等の症状を軽減するために最も有効な薬剤である.ループ利尿薬を基本に,我が国ではフロセミド,トラセミド,
エタクリン酸,ブメタニド,ピレタニド,アゾセミドが用いられる.それぞれの利尿薬間の予後に対する効果に関しては,大規模試験によるエビデンスは得られていない.軽症例ではサイアザイド系利尿薬も用いられ,またループ利尿薬で十分な利尿が得られない場合にはサイアザイド系利尿薬との併用を試みてもよい.ただしこれらの利尿薬は低カリウム血症,低マグネシウム血症を来たしやすく,ジギタリス中毒を誘発しやすいばかりでなく,重症心室性不整脈を誘発することもある.したがってこれらの利尿薬の使用時には血清カリウムおよびマグネシウムの保持を心がける.慢性心不全に関する臨床試験の解析結果では,ループ利尿薬の使用は予後悪化因子であると報告されている168).純粋な水利尿を促進し,電解質異常やRAA系の賦活化を来たしにくいバゾプレッシン阻害薬が使用可能である169),170).
③ アンジオテンシン変換酵素(ACE)阻害薬
このクラスの薬剤の左心機能不全に基づく心不全患者,あるいは心筋梗塞後患者の生命予後,および種々の心血管イベントに対する効果は CONSENSUS171),
SOLVD 172),173)等の大規模臨床試験により確立されている.無症候の左室収縮機能不全についても心不全の入院を抑制し,生命予後を改善することがその後の長期経過観察で明らかになっている174)ので,すべての左室収縮機能低下患者に用いられるべきである.また高用量と低用量を比較した場合,死亡率には差がないものの,死亡または入院に関しては高用量でより効果が得られるとのATLAS 175)の結果もあるので,薬剤の忍容性がある限り(咳嗽の有無,血圧,血清クレアチニン値,血清カリウム値のチェック),増量を試みる.
④ アンジオテンシンⅡ受容体拮抗薬(ARB)
ヒトではアンジオテンシンⅠからⅡへの変換のかなりの部分はACE系ではなく,キマーゼ系によるものであると考えられている.したがって,アンジオテンシンⅡ
の作用をより確実にブロックする薬剤として,ARBが心不全治療に試みられるようになった.まず,ACE阻害薬の投与されていない心不全患者に対する効果におい
ては,我が国の臨床試験ARCH-J においてカンデサルタンがプラセボと比較して心不全の進行(66.7%減少)および心血管イベントを抑制することが報告された176).
ACE阻害薬に忍容性のない患者を対象としたCHARMalternative試験においても,カンデサルタンは心血管死亡または心不全悪化による入院を有意に減少した177).
ACE阻害薬とARBとの比較では,高齢者の心不全患者を対象に,ロサルタンの死亡率に対する有効性をカプトプリルと比較した臨床試験 ELITEⅡ 178)の結果,忍容性においてARBはACE阻害薬より優れていたものの,死亡率改善効果には有意差は得られなかった.心不全および左室収縮機能不全を伴う急性心筋梗塞患者を対象とした大規模試験VALIANTにおいても,ARBのACE阻害薬に対する心血管イベント抑制効果の非劣性が確認されている179).一方,ACE阻害薬の左室リモデリング抑制効果は,副次的に増加するブラジキニンに負うところが大きいとする考え方もあり,ARBとACE阻害薬との併用の効果を検証する大規模臨床試験が行われた.Val-HeFTにおいては利尿薬,ジギタリス,ACE阻害薬等の標準的治療薬が既に投与されている慢性心不全患者へのARBバルサルタンの追加投与は総死亡率を改善しなかった.一方,心不全の悪化による入院を減少させ,症状を軽減しQOLも改善した180).CHARM Added試験でも既にACE阻害薬の投与されている患者において,カンデサルタンは心血管死亡または心不全入院を減少させた181).
以上よりARBは左室収縮機能低下に基づく慢性心不全患者においてACE阻害薬と同等の心血管イベント抑制効果を有し,さらにACE阻害薬に追加することによ
ってもさらなるイベント抑制効果が得られる.したがってACE阻害薬が忍容性等の点で投与できない場合にはARBを用いるべきである.ただし腎機能に及ぼす影響
や高カリウム血症,低血圧等についてはACE阻害薬と同様の注意が必要である.またACE阻害薬,ARB,β遮断薬の三者併用についてはVal-HeFTでは否定的な結
果であったが,その後のCHARMでは肯定的な結果となり,未だ一定の見解が得られていない.
⑤ β遮断薬
US Carvedilol study 182)においてはカルベジロール,CIBISⅡ 161)においてはビソプロロール,MERIT-HF 183)ではコハク酸メトプロロールの有意な生命予後,および心不全悪化防止効果が明らかにされた.我が国では,低用量カルベジロール(1日5 mgおよび20 mg)とプラセボの比較試験,MUCHAにおいて,一年弱という比較的短期間の観察ではあるが,両投与量ともに心血管イベントおよび心不全による入院(71%減少),あるいは死亡または心血管イベントによる入院(91%減少)を
著明に減少させた.LVEFは用量依存的に改善した184).
以上の臨床試験の対象のほとんどはNYHAⅡ度およびⅢ度の患者であり,最も重症のⅣ度患者は少数であった.COPERNICUSでは,LVEFが25%以下のNYHAⅣ度の重症心不全患者においてもカルベジロール投与により35%の死亡率低下が得られた185).個々のβ遮断薬の効果を比較した試験は少ないが,COMETではカルベジロールと酒石酸メトプロロールの効果が比較され,カルベジロール群で死亡率が有意に低かった186).
一方,心不全症状のない左室機能不全患者に対するβ遮断薬のエビデンスも得られている.CAPRICORNでは,LVEFの低下した心筋梗塞患者にカルベジロールを
投与し,死亡率が低下した187).したがって有症状の心不全患者のみならず,無症状の左室収縮機能低下患者においてもβ遮断薬導入を試みることが勧められる.
β遮断薬の投与に際しては,NYHAⅢ度以上の心不全患者は原則として入院とし,体液貯留の兆候がなく,患者の状態が安定していることを確認した上でごく少量
より時間をかけて,数日~2週間ごとに段階的に増量していくことが望ましい.β遮断薬の開始にあたっては,徐脈性不整脈や閉塞性肺疾患等の禁忌となる合併疾患
がないことを確認する.血漿BNP濃度はその忍容性や有効性の指標となる188).カルベジロールを用いる場合は,初期用量を2.5 mg/day(分2)とし,重症例では1.25
mg/dayとする. 以後,3.75または5 mg/day→ 7.5 mg/day→ 10 mg/day→ 15 mg/day→ 20 mg/dayと増量する.増量に際しては自覚症状,脈拍,血圧,心胸比,および心エコー図による心内腔の大きさ等を参考にし,心不全の増悪,過度の低血圧や徐脈の出現に注意する.ACE阻害薬と同様,欧米の臨床試験での目標用量と我が国の常用量との間にかなりの開きがあり,薬剤忍容性をみながら,できるだけ増量すべきとの意見もあるが,至適用量についての明確な結論は出ていない.
β遮断薬開始のタイミングは心不全急性増悪からの回復期で,退院前が望ましい189).初期用量を開始し,以後外来で増量する.また,β遮断薬治療中に心不全増悪を来たした場合,強心薬を使用するときには,PDE阻害薬が望ましい.特にカルベジロール投与中の場合,ドブタミンの使用は血行動態を悪化させることが示されて
いる190).心不全の程度によってはβ遮断薬を中止せざるを得ない場合もあるが,病態が安定したら退院前には必ず再開とする191).
β遮断薬の効果を予測する指標として,様々な検討がなされてきたが,一定の見解は得られていない.最近はアドレナリン受容体シグナル伝達に関わる遺伝子多型がレスポンダー予測に有用との報告がなされている192),193)が,我が国におけるコンセンサスは得られていない.β遮断薬とACE阻害薬のどちらを先に投与するかについて,CBISⅢ研究で検討され,ビソプロロール投与で心不全増悪予防効果が報告された194).
なお慢性心不全における大規模試験のエビデンスのあるβ遮断薬はカルベジロール,ビソプロロール,メトプロロールであるが,このうちカルベジロールのみが我が
国では保険適用となっている.
⑥ 抗アルドステロン薬
NYHAⅢ度以上の左室収縮機能不全に基づく重症心不全患者を対象とした大規模試験(RALES)では,スピロノラクトンの併用が全死亡率,心不全死亡率,突然
死のいずれをも減少させることが明らかとなった38).また,EPHESUS試験でも,急性心筋梗塞後に左心機能不全および心不全を合併した患者では,エプレレノンを
併用すると,死亡および心血管イベントの発生リスクが抑制されることが報告された39).しかし,ACE阻害薬あるいはARBとスピロノラクトンの積極的併用により血清カリウムの上昇に伴う死亡,入院等が増加するとの報告がある195).これら3剤の併用は避けるべきである.高カリウム血症を回避するためには,ベースラインの血清クレアチニン値1.6 mg/dL以上,血清カリウム値5.0mEq/L以上の場合には使用を控えること,初期用量は12.5 mg/day(エプレレノンの場合は25 mg/day)とすること,カリウム製剤や非ステロイド系抗炎症薬との併用を避けること等が挙げられる.開始後3日目,1週後,以後3か月後までは毎月血清カリウム値とクレアチニン値を測定することが望ましい.
⑦ アミオダロン
心臓突然死は,心不全の増悪による死亡とならんで心不全の二大死因であり,その基礎となっているのは心室頻拍および心室細動等の重症心室性不整脈である.アミオダロンはこれらの重症心室性不整脈を抑え,心不全患者の突然死を予防することが期待される.各種の臨床試験では196),197)必ずしも一貫した結果がえられていないが,過去の臨床試験のメタアナリシス198)では,全死亡率および不整脈死を減少させることが報告されている.ただし植込み型除細動器(ICD)との比較を行った大規模試験SCD-HeFTでは,プラセボと比較して有効性がなかった199).使用に際しては,特異的な副作用(甲状腺機能障害,間質性肺炎,角膜色素沈着,肝機能値の異常)の早期検出のため定期的な甲状腺機能,肺機能,胸部X線撮影,血中KL-6 測定,眼科受診等が必要である.
⑧ 末梢血管拡張薬
欧米のガイドラインでは,種々の原因によりACE阻害薬を用いることのできない患者において生命予後の改善を目的として硝酸イソソルビドとヒドララジンの併
用200)が推奨されている.しかし,我が国では積極的には使用されていない.硝酸薬単独の使用では,急性期血行動態の改善は期待できるが,予後改善効果については不明である.
一般にカルシウム拮抗薬は,長期に用いると心不全を悪化させる危険性があり勧められない.血管選択性の高いジヒドロピリジン系カルシウム拮抗薬は,このような
有害事象が少ないとされるが,長期予後を改善するとのコンセンサスは得られていない200).
⑨ 経口強心薬
1980年代から行われた種々の経口強心薬の大規模臨床試験は,ことごとく否定的な結果に終わり201),202),米国では経口強心薬について否定的な見方がなされている.しかしながら,生命予後の改善効果のみが慢性心不全治療の最終目的ではないとの見解にたてば,経口強心薬の臨床的有用性についても再考慮すべきであろう.特に,重症例におけるQOLの改善203),204)を目的とする場合や,静注強心薬からの離脱時,またはβ遮断薬導入時の使用はその有用性に検討の余地がある.我が国におけるNYHA機能分類ⅡmまたはⅢ度の心不全患者を対象としたピモベンダンの臨床所見,EPOCH 205)では52週間の試験期間中,ピモベンダン群ではプラセボ群に比較して複合エンドポイントは大きく減少しSpecific Activity Scale で評価した身体活動能力は改善した.経口強心薬として現在我が国ではピモベンダン,デノパミン,ドカルパミン,ベスナリノンが認可されている.
⑩ ナトリウム利尿ペプチド
本治療薬は,静注でのみ使用可能であり,急性心不全に用いられる.血管拡張作用と神経体液因子抑制効果を有するため,入退院を繰り返す重症心不全例を対象として,ANP製剤カルペリチドの外来での間欠投与が試みられている.ANP製剤であるカルペリチドは,急性増悪期の使用により,死亡・再入院が抑制されるとの小規
模なデータ57)がある.多数例を対象としたFUSIONⅡ試験206)において有用性は認められなかった.
心不全ステージ別にみた薬物治療 (図4)
ステージA(危険因子を有するが,心機能障害がない)
高血圧,耐糖能異常,脂質異常症,喫煙等の危険因子を有する場合には,それぞれのガイドラインにしたがって是正・治療を行う.これらの危険因子を伴う高血圧や
糖尿病がある場合には,積極的にACE阻害薬を開始する.また,既に冠動脈疾患を発症している場合にはACE阻害薬はその二次予防に有用である207).ACE阻害
薬に対する忍容性に乏しい場合には,ARBを使用する.
ステージB(無症状の左室収縮機能不全)
まずACE阻害薬が適応となる.ACE阻害薬の投与が副作用等で使用不可能な症例では,ARBを投与する.心筋梗塞後の左室収縮機能不全であればβ遮断薬の導入も考慮する.心房細動による頻脈を伴う症例ではジギタリスを用いる.
ステージC(症候性心不全)
NYHAⅡ度:ACE阻害薬に加えてβ遮断薬導入を行う.肺うっ血所見や全身浮腫等体液貯留による症状が明らかである場合には,ループ利尿薬,サイアザイド系利尿薬を用いる.洞調律で重症心室性不整脈を伴わない非虚血性心筋症には,低用量ジゴキシンの使用を考慮する.NYHAⅡm以上では他の薬剤で症状の改善が得られない場合,不整脈増悪に注意を払いながらピモベンダンを追加してもよい.
NYHAⅢ度:NYHAⅡ度と同様,ACE阻害薬,β遮断薬,ループ利尿薬,サイアザイド系利尿薬,ジゴキシンを用いる.スピロノラクトンを追加する.QOL改善,さらなる心血管イベントの抑制を目的としたピモベンダンの追加を行ってもよい.
NYHAⅣ度:入院とする.カテコラミン,フォスフォジエステラーゼⅢ阻害薬,利尿薬,カルペリチド等の非経口投与を行い状態の安定化を図る.状態の安定化が得られたならACE阻害薬,スピロノラクトンを含む利尿薬,ジギタリス等の経口心不全治療薬への切り替えを行い,さらにβ遮断薬導入を試みる.
ステージD(治療抵抗性心不全)
体液管理と薬物治療が適正かもう一度見直す.心臓移植の適応について検討する.積極的治療によっても予後改善が期待されない場合は,本人や家族の同意のもとで苦痛の解除を主眼とする末期医療ケアを行う.この場合,ICDの作動を解除する.
経口心不全治療薬の選択
(表10に主な心不全治療薬の用量を示す)
ClassⅠ
● ACE阻害薬:禁忌を除きすべての患者に対する使用(無症状の患者も含む)(エビデンスレベルA)
● ARB:ACE阻害薬に忍容性のない患者に対する投与(エビデンスレベルA)
● β遮断薬またはジゴキシン:頻脈性心房細動を有する患者にレートコントロールを目的に使用(エビデンスレベルB)
● β遮断薬:有症状の患者に対し予後の改善を目的とした導入(エビデンスレベルA)
● ループ利尿薬,サイアザイド系利尿薬:うっ血に基づく症状を有する患者に対する使用(エビデンスレベルC)
● 抗アルドステロン薬:ループ利尿薬,ACE阻害薬が既に投与されているNYHAⅢ度以上の重症患者に対する投与(エビデンスレベルA)
ClassⅡ a
● ジギタリス(血中濃度0.8 ng/mL以下で維持):洞調律の患者に対する投与(エビデンスレベルB)
● ARBとACE阻害薬との併用(エビデンスレベルB)
● 経口強心薬短期使用:QOLの改善,経静脈的強心薬からの離脱を目的に短期投与(エビデンスレベルB)
● β遮断薬:無症状の左室収縮機能不全患者における導入(エビデンスレベルB)
● アミオダロン:重症心室性不整脈とそれに基づく心停止の既往のある患者における投与(エビデンスレベルB)
ClassⅡb
● 硝酸イソソルビドとヒドララジンの併用:ACE阻害薬,あるいはARBの代用(エビデンスレベルB)
● 経口強心薬:β遮断薬導入時の併用(エビデンスレベルB)
● ループ利尿薬,サイアザイド系利尿薬,抗アルドステロン薬以外の利尿薬(エビデンスレベルC)
ClassⅢ
● 経口強心薬の長期使用:無症状の患者に対する長期投与(エビデンスレベルC)
● カルシウム拮抗薬:狭心症,高血圧を合併していない患者に対する使用(エビデンスレベルB)
● Vaughan Williams分類ClassⅠ群抗不整脈薬の長期経口使用(エビデンスレベルB)
なっている.ここではこのような世界的傾向をふまえた上で,我が国の事情に即した薬物治療のガイドラインを提供することを目標とした.抗凝固薬,アミオダロン以外の抗不整脈薬については他の項を,また収縮機能障害による慢性心不全の急性増悪時の治療は「急性重症心不全治療ガイドライン」を参照されたい.
① ジギタリス
1997年にDIGの結果が発表され,ジゴキシンが洞調律心不全患者の心不全増悪による入院を減らすことが明らかとなったが予後は改善しなかった162). DIGのサ
ブスタディーではジゴキシン血中濃度に比例して死亡率が増加することが明らかにされており,LVEF 45%以下の洞調律の心不全患者の至適血中濃度として,0.5~ 0.8ng/mLが提案されている166).
DIG 162)ではジゴキシンが不整脈に関連した死亡をむしろ増加させる傾向にある.またDIGの別のサブスタディーでは,ジゴキシンは女性心不全患者においてはむ
しろ予後を悪化させるというエビデンスも得られている167)のでこれらの患者群における使用は注意を要する.
一方,心房細動を伴う心不全患者においては,心拍数をコントロールし十分な左室充満時間を得るためにジギタリスが用いられる.これは臨床症状の改善を目的と
するものであって,心房細動を伴う左室収縮機能不全患者においてジギタリスが予後を改善するかどうかに関するエビデンスはない.また左室収縮機能低下に基づく
心不全患者の心房細動のレートコントロールにジギタリスが最適であるかどうかについてもエビデンスも得られていない.
ジゴキシン以外のジギタリス製剤が心不全のコントロールにおいてジゴキシンよりも優れているという明らかなエビデンスは得られていない.
② 利尿薬
心不全患者のうっ血に基づく労作時呼吸困難,浮腫等の症状を軽減するために最も有効な薬剤である.ループ利尿薬を基本に,我が国ではフロセミド,トラセミド,
エタクリン酸,ブメタニド,ピレタニド,アゾセミドが用いられる.それぞれの利尿薬間の予後に対する効果に関しては,大規模試験によるエビデンスは得られていない.軽症例ではサイアザイド系利尿薬も用いられ,またループ利尿薬で十分な利尿が得られない場合にはサイアザイド系利尿薬との併用を試みてもよい.ただしこれらの利尿薬は低カリウム血症,低マグネシウム血症を来たしやすく,ジギタリス中毒を誘発しやすいばかりでなく,重症心室性不整脈を誘発することもある.したがってこれらの利尿薬の使用時には血清カリウムおよびマグネシウムの保持を心がける.慢性心不全に関する臨床試験の解析結果では,ループ利尿薬の使用は予後悪化因子であると報告されている168).純粋な水利尿を促進し,電解質異常やRAA系の賦活化を来たしにくいバゾプレッシン阻害薬が使用可能である169),170).
③ アンジオテンシン変換酵素(ACE)阻害薬
このクラスの薬剤の左心機能不全に基づく心不全患者,あるいは心筋梗塞後患者の生命予後,および種々の心血管イベントに対する効果は CONSENSUS171),
SOLVD 172),173)等の大規模臨床試験により確立されている.無症候の左室収縮機能不全についても心不全の入院を抑制し,生命予後を改善することがその後の長期経過観察で明らかになっている174)ので,すべての左室収縮機能低下患者に用いられるべきである.また高用量と低用量を比較した場合,死亡率には差がないものの,死亡または入院に関しては高用量でより効果が得られるとのATLAS 175)の結果もあるので,薬剤の忍容性がある限り(咳嗽の有無,血圧,血清クレアチニン値,血清カリウム値のチェック),増量を試みる.
④ アンジオテンシンⅡ受容体拮抗薬(ARB)
ヒトではアンジオテンシンⅠからⅡへの変換のかなりの部分はACE系ではなく,キマーゼ系によるものであると考えられている.したがって,アンジオテンシンⅡ
の作用をより確実にブロックする薬剤として,ARBが心不全治療に試みられるようになった.まず,ACE阻害薬の投与されていない心不全患者に対する効果におい
ては,我が国の臨床試験ARCH-J においてカンデサルタンがプラセボと比較して心不全の進行(66.7%減少)および心血管イベントを抑制することが報告された176).
ACE阻害薬に忍容性のない患者を対象としたCHARMalternative試験においても,カンデサルタンは心血管死亡または心不全悪化による入院を有意に減少した177).
ACE阻害薬とARBとの比較では,高齢者の心不全患者を対象に,ロサルタンの死亡率に対する有効性をカプトプリルと比較した臨床試験 ELITEⅡ 178)の結果,忍容性においてARBはACE阻害薬より優れていたものの,死亡率改善効果には有意差は得られなかった.心不全および左室収縮機能不全を伴う急性心筋梗塞患者を対象とした大規模試験VALIANTにおいても,ARBのACE阻害薬に対する心血管イベント抑制効果の非劣性が確認されている179).一方,ACE阻害薬の左室リモデリング抑制効果は,副次的に増加するブラジキニンに負うところが大きいとする考え方もあり,ARBとACE阻害薬との併用の効果を検証する大規模臨床試験が行われた.Val-HeFTにおいては利尿薬,ジギタリス,ACE阻害薬等の標準的治療薬が既に投与されている慢性心不全患者へのARBバルサルタンの追加投与は総死亡率を改善しなかった.一方,心不全の悪化による入院を減少させ,症状を軽減しQOLも改善した180).CHARM Added試験でも既にACE阻害薬の投与されている患者において,カンデサルタンは心血管死亡または心不全入院を減少させた181).
以上よりARBは左室収縮機能低下に基づく慢性心不全患者においてACE阻害薬と同等の心血管イベント抑制効果を有し,さらにACE阻害薬に追加することによ
ってもさらなるイベント抑制効果が得られる.したがってACE阻害薬が忍容性等の点で投与できない場合にはARBを用いるべきである.ただし腎機能に及ぼす影響
や高カリウム血症,低血圧等についてはACE阻害薬と同様の注意が必要である.またACE阻害薬,ARB,β遮断薬の三者併用についてはVal-HeFTでは否定的な結
果であったが,その後のCHARMでは肯定的な結果となり,未だ一定の見解が得られていない.
⑤ β遮断薬
US Carvedilol study 182)においてはカルベジロール,CIBISⅡ 161)においてはビソプロロール,MERIT-HF 183)ではコハク酸メトプロロールの有意な生命予後,および心不全悪化防止効果が明らかにされた.我が国では,低用量カルベジロール(1日5 mgおよび20 mg)とプラセボの比較試験,MUCHAにおいて,一年弱という比較的短期間の観察ではあるが,両投与量ともに心血管イベントおよび心不全による入院(71%減少),あるいは死亡または心血管イベントによる入院(91%減少)を
著明に減少させた.LVEFは用量依存的に改善した184).
以上の臨床試験の対象のほとんどはNYHAⅡ度およびⅢ度の患者であり,最も重症のⅣ度患者は少数であった.COPERNICUSでは,LVEFが25%以下のNYHAⅣ度の重症心不全患者においてもカルベジロール投与により35%の死亡率低下が得られた185).個々のβ遮断薬の効果を比較した試験は少ないが,COMETではカルベジロールと酒石酸メトプロロールの効果が比較され,カルベジロール群で死亡率が有意に低かった186).
一方,心不全症状のない左室機能不全患者に対するβ遮断薬のエビデンスも得られている.CAPRICORNでは,LVEFの低下した心筋梗塞患者にカルベジロールを
投与し,死亡率が低下した187).したがって有症状の心不全患者のみならず,無症状の左室収縮機能低下患者においてもβ遮断薬導入を試みることが勧められる.
β遮断薬の投与に際しては,NYHAⅢ度以上の心不全患者は原則として入院とし,体液貯留の兆候がなく,患者の状態が安定していることを確認した上でごく少量
より時間をかけて,数日~2週間ごとに段階的に増量していくことが望ましい.β遮断薬の開始にあたっては,徐脈性不整脈や閉塞性肺疾患等の禁忌となる合併疾患
がないことを確認する.血漿BNP濃度はその忍容性や有効性の指標となる188).カルベジロールを用いる場合は,初期用量を2.5 mg/day(分2)とし,重症例では1.25
mg/dayとする. 以後,3.75または5 mg/day→ 7.5 mg/day→ 10 mg/day→ 15 mg/day→ 20 mg/dayと増量する.増量に際しては自覚症状,脈拍,血圧,心胸比,および心エコー図による心内腔の大きさ等を参考にし,心不全の増悪,過度の低血圧や徐脈の出現に注意する.ACE阻害薬と同様,欧米の臨床試験での目標用量と我が国の常用量との間にかなりの開きがあり,薬剤忍容性をみながら,できるだけ増量すべきとの意見もあるが,至適用量についての明確な結論は出ていない.
β遮断薬開始のタイミングは心不全急性増悪からの回復期で,退院前が望ましい189).初期用量を開始し,以後外来で増量する.また,β遮断薬治療中に心不全増悪を来たした場合,強心薬を使用するときには,PDE阻害薬が望ましい.特にカルベジロール投与中の場合,ドブタミンの使用は血行動態を悪化させることが示されて
いる190).心不全の程度によってはβ遮断薬を中止せざるを得ない場合もあるが,病態が安定したら退院前には必ず再開とする191).
β遮断薬の効果を予測する指標として,様々な検討がなされてきたが,一定の見解は得られていない.最近はアドレナリン受容体シグナル伝達に関わる遺伝子多型がレスポンダー予測に有用との報告がなされている192),193)が,我が国におけるコンセンサスは得られていない.β遮断薬とACE阻害薬のどちらを先に投与するかについて,CBISⅢ研究で検討され,ビソプロロール投与で心不全増悪予防効果が報告された194).
なお慢性心不全における大規模試験のエビデンスのあるβ遮断薬はカルベジロール,ビソプロロール,メトプロロールであるが,このうちカルベジロールのみが我が
国では保険適用となっている.
⑥ 抗アルドステロン薬
NYHAⅢ度以上の左室収縮機能不全に基づく重症心不全患者を対象とした大規模試験(RALES)では,スピロノラクトンの併用が全死亡率,心不全死亡率,突然
死のいずれをも減少させることが明らかとなった38).また,EPHESUS試験でも,急性心筋梗塞後に左心機能不全および心不全を合併した患者では,エプレレノンを
併用すると,死亡および心血管イベントの発生リスクが抑制されることが報告された39).しかし,ACE阻害薬あるいはARBとスピロノラクトンの積極的併用により血清カリウムの上昇に伴う死亡,入院等が増加するとの報告がある195).これら3剤の併用は避けるべきである.高カリウム血症を回避するためには,ベースラインの血清クレアチニン値1.6 mg/dL以上,血清カリウム値5.0mEq/L以上の場合には使用を控えること,初期用量は12.5 mg/day(エプレレノンの場合は25 mg/day)とすること,カリウム製剤や非ステロイド系抗炎症薬との併用を避けること等が挙げられる.開始後3日目,1週後,以後3か月後までは毎月血清カリウム値とクレアチニン値を測定することが望ましい.
⑦ アミオダロン
心臓突然死は,心不全の増悪による死亡とならんで心不全の二大死因であり,その基礎となっているのは心室頻拍および心室細動等の重症心室性不整脈である.アミオダロンはこれらの重症心室性不整脈を抑え,心不全患者の突然死を予防することが期待される.各種の臨床試験では196),197)必ずしも一貫した結果がえられていないが,過去の臨床試験のメタアナリシス198)では,全死亡率および不整脈死を減少させることが報告されている.ただし植込み型除細動器(ICD)との比較を行った大規模試験SCD-HeFTでは,プラセボと比較して有効性がなかった199).使用に際しては,特異的な副作用(甲状腺機能障害,間質性肺炎,角膜色素沈着,肝機能値の異常)の早期検出のため定期的な甲状腺機能,肺機能,胸部X線撮影,血中KL-6 測定,眼科受診等が必要である.
⑧ 末梢血管拡張薬
欧米のガイドラインでは,種々の原因によりACE阻害薬を用いることのできない患者において生命予後の改善を目的として硝酸イソソルビドとヒドララジンの併
用200)が推奨されている.しかし,我が国では積極的には使用されていない.硝酸薬単独の使用では,急性期血行動態の改善は期待できるが,予後改善効果については不明である.
一般にカルシウム拮抗薬は,長期に用いると心不全を悪化させる危険性があり勧められない.血管選択性の高いジヒドロピリジン系カルシウム拮抗薬は,このような
有害事象が少ないとされるが,長期予後を改善するとのコンセンサスは得られていない200).
⑨ 経口強心薬
1980年代から行われた種々の経口強心薬の大規模臨床試験は,ことごとく否定的な結果に終わり201),202),米国では経口強心薬について否定的な見方がなされている.しかしながら,生命予後の改善効果のみが慢性心不全治療の最終目的ではないとの見解にたてば,経口強心薬の臨床的有用性についても再考慮すべきであろう.特に,重症例におけるQOLの改善203),204)を目的とする場合や,静注強心薬からの離脱時,またはβ遮断薬導入時の使用はその有用性に検討の余地がある.我が国におけるNYHA機能分類ⅡmまたはⅢ度の心不全患者を対象としたピモベンダンの臨床所見,EPOCH 205)では52週間の試験期間中,ピモベンダン群ではプラセボ群に比較して複合エンドポイントは大きく減少しSpecific Activity Scale で評価した身体活動能力は改善した.経口強心薬として現在我が国ではピモベンダン,デノパミン,ドカルパミン,ベスナリノンが認可されている.
⑩ ナトリウム利尿ペプチド
本治療薬は,静注でのみ使用可能であり,急性心不全に用いられる.血管拡張作用と神経体液因子抑制効果を有するため,入退院を繰り返す重症心不全例を対象として,ANP製剤カルペリチドの外来での間欠投与が試みられている.ANP製剤であるカルペリチドは,急性増悪期の使用により,死亡・再入院が抑制されるとの小規
模なデータ57)がある.多数例を対象としたFUSIONⅡ試験206)において有用性は認められなかった.
心不全ステージ別にみた薬物治療 (図4)
ステージA(危険因子を有するが,心機能障害がない)
高血圧,耐糖能異常,脂質異常症,喫煙等の危険因子を有する場合には,それぞれのガイドラインにしたがって是正・治療を行う.これらの危険因子を伴う高血圧や
糖尿病がある場合には,積極的にACE阻害薬を開始する.また,既に冠動脈疾患を発症している場合にはACE阻害薬はその二次予防に有用である207).ACE阻害
薬に対する忍容性に乏しい場合には,ARBを使用する.
ステージB(無症状の左室収縮機能不全)
まずACE阻害薬が適応となる.ACE阻害薬の投与が副作用等で使用不可能な症例では,ARBを投与する.心筋梗塞後の左室収縮機能不全であればβ遮断薬の導入も考慮する.心房細動による頻脈を伴う症例ではジギタリスを用いる.
ステージC(症候性心不全)
NYHAⅡ度:ACE阻害薬に加えてβ遮断薬導入を行う.肺うっ血所見や全身浮腫等体液貯留による症状が明らかである場合には,ループ利尿薬,サイアザイド系利尿薬を用いる.洞調律で重症心室性不整脈を伴わない非虚血性心筋症には,低用量ジゴキシンの使用を考慮する.NYHAⅡm以上では他の薬剤で症状の改善が得られない場合,不整脈増悪に注意を払いながらピモベンダンを追加してもよい.
NYHAⅢ度:NYHAⅡ度と同様,ACE阻害薬,β遮断薬,ループ利尿薬,サイアザイド系利尿薬,ジゴキシンを用いる.スピロノラクトンを追加する.QOL改善,さらなる心血管イベントの抑制を目的としたピモベンダンの追加を行ってもよい.
NYHAⅣ度:入院とする.カテコラミン,フォスフォジエステラーゼⅢ阻害薬,利尿薬,カルペリチド等の非経口投与を行い状態の安定化を図る.状態の安定化が得られたならACE阻害薬,スピロノラクトンを含む利尿薬,ジギタリス等の経口心不全治療薬への切り替えを行い,さらにβ遮断薬導入を試みる.
ステージD(治療抵抗性心不全)
体液管理と薬物治療が適正かもう一度見直す.心臓移植の適応について検討する.積極的治療によっても予後改善が期待されない場合は,本人や家族の同意のもとで苦痛の解除を主眼とする末期医療ケアを行う.この場合,ICDの作動を解除する.
経口心不全治療薬の選択
(表10に主な心不全治療薬の用量を示す)
ClassⅠ
● ACE阻害薬:禁忌を除きすべての患者に対する使用(無症状の患者も含む)(エビデンスレベルA)
● ARB:ACE阻害薬に忍容性のない患者に対する投与(エビデンスレベルA)
● β遮断薬またはジゴキシン:頻脈性心房細動を有する患者にレートコントロールを目的に使用(エビデンスレベルB)
● β遮断薬:有症状の患者に対し予後の改善を目的とした導入(エビデンスレベルA)
● ループ利尿薬,サイアザイド系利尿薬:うっ血に基づく症状を有する患者に対する使用(エビデンスレベルC)
● 抗アルドステロン薬:ループ利尿薬,ACE阻害薬が既に投与されているNYHAⅢ度以上の重症患者に対する投与(エビデンスレベルA)
ClassⅡ a
● ジギタリス(血中濃度0.8 ng/mL以下で維持):洞調律の患者に対する投与(エビデンスレベルB)
● ARBとACE阻害薬との併用(エビデンスレベルB)
● 経口強心薬短期使用:QOLの改善,経静脈的強心薬からの離脱を目的に短期投与(エビデンスレベルB)
● β遮断薬:無症状の左室収縮機能不全患者における導入(エビデンスレベルB)
● アミオダロン:重症心室性不整脈とそれに基づく心停止の既往のある患者における投与(エビデンスレベルB)
ClassⅡb
● 硝酸イソソルビドとヒドララジンの併用:ACE阻害薬,あるいはARBの代用(エビデンスレベルB)
● 経口強心薬:β遮断薬導入時の併用(エビデンスレベルB)
● ループ利尿薬,サイアザイド系利尿薬,抗アルドステロン薬以外の利尿薬(エビデンスレベルC)
ClassⅢ
● 経口強心薬の長期使用:無症状の患者に対する長期投与(エビデンスレベルC)
● カルシウム拮抗薬:狭心症,高血圧を合併していない患者に対する使用(エビデンスレベルB)
● Vaughan Williams分類ClassⅠ群抗不整脈薬の長期経口使用(エビデンスレベルB)
1 収縮機能障害に対する治療
図4 心不全の重症度からみた薬物治療指針
表10 主な経口心不全治療薬の用量

* 我が国で慢性心不全に対する保険適用が認められていないもの.
** Jelliffe RW, Brooker GA. A nomogram for digoxin therapy. Am J Med 1974; 57: 63-68
† 心不全におけるスピロノラクトンの投与量は25~50 mg/dayが妥当である.
国内で承認された適応症・用量は心不全の保険適用が認められている薬剤ではその投与量を,認められていない薬剤では承認され
ている他の疾患に対する投与量を記載した.
** Jelliffe RW, Brooker GA. A nomogram for digoxin therapy. Am J Med 1974; 57: 63-68
† 心不全におけるスピロノラクトンの投与量は25~50 mg/dayが妥当である.
国内で承認された適応症・用量は心不全の保険適用が認められている薬剤ではその投与量を,認められていない薬剤では承認され
ている他の疾患に対する投与量を記載した.
Ⅱ 慢性心不全の治療 >
2 薬物療法 >
1 収縮機能障害に対する治療

慢性心不全治療ガイドライン(2010年改訂版)
Guidelines for Treatment of Chronic Heart Failure(JCS 2010)
Guidelines for Treatment of Chronic Heart Failure(JCS 2010)